Sto studiando per l'esame di stato per l'abilitazione alla professione di ingegnere. Oggi ho fatto un tema di esame (eh si, anche dopo la laurea si contua a fare i temi) e poichè sono abbastanza soddisfatto del mio lavoro ho deciso di pubblicarlo (che megalomane che sono).
In ingegneria chimica tutte le conoscenze hanno come scopo principale il saper agire, intervenire e/o progettare un processo chimico. Il tema richiedeva di descrivere gli aspetti fondamentali delle operazioni unitarie di un tipico processo dell'industria chimica.
Spero sia comprensibile a tutti.
Un processo è generalmente definibile come un metodo da seguire per ottenere un determinato obiettivo. Nel processo chimico l'obiettivo è la trasformazione di una materia prima di un determinato valore in un prodotto di valore superiore.
Ogni processo chimico è costituito da una sequenza logica di operazioni unitarie che, nel loro insieme, realizzano la trasformazione desiderata. Ogni logica di processo determina la scelta e la collocazione delle varie unità atte a raggiungere gli scopi prefissati.

Le principali unità tipiche di un processo chimico sono il reattore chimico, le unità di separazione e gli scambiatori di calore.
Il reattore chimico può essere immaginato come un contenitore con caratteristiche specifiche in cui viene sfruttata una reazione chimica per ottenere del valore aggiunto. É l'unità principale di un processo chimico, il punto da cui parte la progettazione. Il tipo di reattore è principalmente individuabile dalle sue dimensioni e dalle sue condizioni di funzionamento. Le sue caratteristiche solitamente variano con le coordinate spaziali e temporali, per questo motivo ogni reattore viene assimilato ad un reattore ideale con la sua relativa equazione differenziale che ne descrive il comportamento, notoriamente chiamata equazione di progetto.

Dei reattori in cui possono avvenire reazioni omogenee generalmente è possibile fare una classificazione; questi possono essere suddivisi in: reattore discontinuo, il reattore continuo in regime stazionario e il reattore continuo in regime variabile o semi-continuo. Il primo, semplice da progettare e con poche utility richieste, viene usato spesso per piccole produzioni o per studi di laboratorio. Il reattore continuo in regime stazionario è ideale per le produzioni su scala industriale e, pur richiedendo numerose utility, permette un ottimo controllo delle prestazioni. Il reattore semi-continuo solitamente è un apparecchiatura molto versatile che però richiede uno studio più complesso in quanto le relazioni sono più numerose. Il funzionamento di un reattore chimico continuo può essere semplificato come segue: dei reagenti reagiscono in un contenitore che ospita la reazione chimica, una parte di loro reagisce e diventa prodotti. Il contenitore che ospita la reazione deve avere necessariamente un ingresso ed un uscita. Il tipo di ingresso/uscita del reattore varia a seconda del tipo di materiale disponibile, dalla loro purezza e dagli eventuali problemi legati allo stoccaggio. La qualità e la portata delle correnti dipendono dai ricicli, dagli spurghi e dalle unità di separazione.

Quest'ultime sono le apparecchiature più importanti, seconde solo ai reattori, che servono a portare le correnti alle composizioni desiderate.
Le principali operazioni di separazione sono la separazione flash, la distillazione, l'assorbimento e l'estrazione. La separazione flash è la più semplice tra tutte in quanto consiste nella creazione di uno stato di equilibrio liquido/vapore mediante la variazione di pressione o temperatura e il prelevamento delle due fasi che si creano. Inequivocabilmente la fase vapore sarà sempre più ricca dei componenti più volatili e la fase liquida dei componenti meno volatili.
La distillazione, proprio come il flash, sfrutta per la separazione la differenza di volatilità dei componenti della miscela da trattare con la sola differenza che ha più stadi di equilibrio per singola unità. Con una colonna di distillazione si può ottenere un distillato (la corrente di testa) di purezza superiore a quella ottenibile da una semplice separazione flash che comprende un unico stadio di equilibrio.
L'assorbimento è quella separazione che sfrutta la solubilità tra le fasi, in particolare la solubilità di un gas in un liquido. In pratica, se si vuole recuperare un composto da una miscela di gas, si sceglie un liquido che lo solubilizzi con efficacia e che sia selettivo, ossia che non solubilizzi anche i gas non desiderati, e si manda in controcorrente con la corrente di gas da trattare. Ci sarebbero altre specifiche per la scelta del liquido solvente ma risulterebbe inadeguato trattarli in questa sede. Le colonne di assorbimento possono essere a stadi o a riempimento e la scelta va fatta a seconda delle proprietà fisico-chimiche della corrente di gas, di liquido e dell'eventuale riempimento.
L'estrazione, infine, sfrutta invece la miscibilità, in particolare la ripartizione di un soluto tra due fasi immiscibili (solvente e inerte). Le due fasi immiscibili possono essere entrambe liquide oppure una delle due solida. Un estrazione è fisicamente una successione di stadi di equilibrio configurate a seconda delle necessità. Di solito lo scopo di questa operazione unitaria è quello di trasferire il soluto in un'altra fase più facilmente separabile mediante una distillazione. Per questo motivo essa trova applicazione in tutti quei casi in cui le miscele sono poco convenienti da separare con gli altri metodi a causa di svantaggi tecnici o economici. Mentre le unità di separazione portano le correnti alla qualità desiderata, per fissare temperature e pressione sono necessarie le utility.
Le utility sono tutte quelle unità che da sole non sono in grado di costituire un processo chimico, non cambiano la composizione delle correnti ma servono per portare le variabili termodinamiche di temperatura e pressione ai valori desiderati. Per fissare la pressione esistono le valvole, i compressori e le turbine che per necessità di tempo non potranno essere trattate. Per fissare la temperatura invece esistono gli scambiatori di calore.
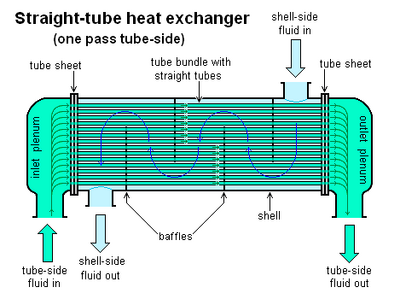
Queste sono apparecchiature nelle quali si ha un trasferimento di energia termica, generalmente da un fluido ad un altro. I due fluidi, banalmente, vengono denominati fluido freddo e fluido caldo. Uno scambiatore di calore, a seconda dello scopo, può essere chiamato condensatore, riscaldatore, evaporatore o refrigeratore. Esistono numerose tipologie di scambiatori, la più semplice ed emblematica è costituita da un tubo dove all'interno scorre una corrente e all'esterno ne scorre un'altra. Solitamente si tende ad utilizzare gli scambiatori a tubo e mantello (shell) costituiti da un tubo coassiale ad un altro tubo, che appunto costituisce il mantello. I tubo interno può variare come forma o come numero, da qui la forma a serpentino, il doppio tubo o il fascio tubiero. Il mantello solitamente varia nella forma in funzione della necessità. Ciò che unisce i tubi concentrici sono le testate che variano a seconda del tipo di flusso, lo scopo e le condizioni operative.
A conclusione, si desume che un processo chimico, per essere considerato tale, deve avere almeno una reazione o una separazione. Tutte le operazioni unitarie in fase di progettazione andranno trattate seguendo le metodologie più moderne non tenendo conto soltanto le unità in se ma correggendo, possibilmente in modo iterativo, il progetto del processo con considerazioni globali riguardanti l'integrazione tra le unità, il controllo facilitato delle variabili critiche e la scelta dei siti delle apparecchiature.
Più il processo sarà semplice, più sarà facile effettuare interventi.
Più il processo sarà robusto, meno rischi ci saranno per l'impianto.

 Quest'ultime sono le apparecchiature più importanti, seconde solo ai reattori, che servono a portare le correnti alle composizioni desiderate.
Quest'ultime sono le apparecchiature più importanti, seconde solo ai reattori, che servono a portare le correnti alle composizioni desiderate.




Salve!!! Se nello scambiatore di calore la corrente fredda rista essere una miscela di due componenti come valuto il calore necessario a portare la temperatura di bolla a quella di rugiada? Inoltre qualora il fluido caldo fosse acqua alla sua temperatura di saturazione, e passa da titolo di vapore pari ad uno a titolo 0,4 come valuto il coefficiente di trasporto?
RispondiEliminaCiao, ho letto ora il tuo commento.
RispondiEliminaFLUIDO FREDDO
Per prima cosa bisogna vedere di che natura è la miscela. Se fosse una miscela ideale (molto probabile) puoi con buona approssimazione fare la media pesata (massica) delle proprietà termodinamiche e comportarti poi come se avessi un nuovo fluido puro.
FLUIDO CALDO
Questo caso non l'ho mai affrontato. Io comunque cercherei i dati del coefficiente di trasporto dell'acqua liquida e dell'acqua vapore e poi cercherei di combinarli nel modo più appropriato, magari con l'aiuto di qualche libro che ne parla.
Scusa se non ti sono stato molto di aiuto, spero di averti dato qualche input.
Hai qualche libro in pdf per caso? tipo il Kern?
RispondiEliminati ringrazio tantissimo Ingegnere!!
RispondiEliminaeheh, ancora non lo sono. Dopo l'esame di stato, tra otto mesi, se tutto va bene lo sarò :)
RispondiEliminaCiao
Salve studio tecnologia dei fluidi e volevo chiedere questo........ scambiatori di calore in continuo o in discontinuo (per il primo caso faccio l es. di un fluido freddo che scorre in un tubo per riscaqldarsi e per il secondo caso una vasca con dentro una serpentina che scalda una quantità di fluido nota) come risulta lo scambio di calore per entrambi, stazionario? o non stazionario?
RispondiEliminaio penso stazionario per il primo e non stazionario per il secondo ma ero interessato ad un suo parere visto la competenza.grazie
Ciao,
RispondiEliminaprima di tutto bisogna definire la parola "stazionaria".
Una relazione (un equazione) che descrive un apparecchiatura in regime stazionario è una relazione dove non compare il tempo come variabile. Al contrario in regime transitorio (non stazionario) il tempo compare come variabile.
Per fartela semplice, ti faccio un esempio cosi capisci meglio.
Quando accendi il forno di casa a 200°C per fare una torta (il forno ha proprio un serpentino se ci fai caso)si sono due fasi distinte:
TRANSITORIO
La fase transitoria, ossia quella fase in cui il forno deve raggiungere la temperatura di 220°C partendo dalla temperatura ambiente (assumi 25°C). In quel caso la temperatura è funzione del tempo, ciò dipende dal tempo che trascorre.
Assumendo che la temperatura salga di 1°C al secondo si avrebbe una relazione del tipo:
T= 25 + at (dove a=1°C/s)
Questa dipendenza dal tempo mi dice che in questa fase il forno funziona in regime non stazionario. Di conseguenza, tutte le variabili che dipendono dalla temperatura (quindi anche la potenza termica scabiata) sono dipendenti dal tempo.
STAZIONARIO
Quando invece nel forno si raggiungono i 220°C la temperatura non dipende più dal tempo. In qualsiasi momento misuri un T vedrai che è sempre di 220°C. In quel caso la potenza termica è una costante.
Per l'esempio che mi dicevi sopra, diciamo che in teoria tutti e due hanno le due fasi menzionate sopra, solo che nello scambiatore di calore la fase transitoria è cosi breve rispetto a quella stazionaria che si può definire trascurabile. Potresti tranquillamente assumere che sia in fase stazionaria.
Per la vasca invece succede la stessa cosa del forno, ovviamente dipende dal grado di miscelazione della vasca (se mescoli si riscalda prima) e dalla sua forma ma immagino che sia una normalissima vasca con acqua stagnante.
Se fai le ipotesi che la fase transitoria, ossia che il tempo in cui tutta l'acqua raggiunge la T della serpentina, sia brevissima (poco probabile) allora devi dire che il secondo caso è stazionario.
Se invece ipotizzi che la vasca si riscaldi molto lentamente, cosi lentamente che raggiungerebbe la T della serpentina ad un tempo elevato, puoi dire che la vasca funziona in regime transitorio.
Per esperienza, di solito la vasca è l'esempio che si fa per illustrare il regime transitorio, quindi puoi tranquillamente dire che ha un funzionamento non stazionario.
Spero di averti chiarito le idee.
Saluti
Grazie molte è stato chiarissimo in altre parole adesso posso dire che secondo me:
RispondiEliminail fluido che scorre in un tubo per riscaldarsi mantiene un DT costante nel tempo, mi spiego, se prendiamo in esame un segmento del tubo qualsiasi parte del fluido che scorre, e che si depositerà su quel segmento per scambiare calore, lo farà con un DT costante nel tempo e questo fa si che il trasporto di calore sia stazionario mentre,
per la vasca il DT cambia nel tempo e quindi la quantità di calore sarà in funzione del DT e del tempo stesso.Nel mio caso devo portare del latte alla temperatura di 80 gradi fino al raggiungimento della quale avrò trasporto non stazionario.
Ho capito bene?è stata una bella sorpresa ricevere la sua risposta,grazie!
Vedo che hai capito perfettamente. Per la risposta che hai ricevuto sei stato fortunato a trovarmi, di solito non mi connetto sempre.
RispondiEliminaBuona giornata.
che differenza c'è tra un fluido di processo e un fluido di servizio?
RispondiEliminaUn Fluido di servizio è un fluido che non serve alla reazione fondamentale del processo chimico. Ad esempio un fluido di servizio è l'acqua di raffreddamento.
RispondiEliminaUn fluido di processo non l'ho mai sentito, in genere non ho mai avuto la necessità di fare questa distinzione. Per esclusione direi che un fluido di processo potrebbe essere uno dei fluidi che serve effettivamente al processo chimico sia come reagente che come prodotto.
Dato che però non l'ho mai sentito, è meglio che chiedi al prof per una conferma.
Salve ingegnere, riccorro nuovamente al suo aiuto!!
RispondiEliminaArgomento: volume specifico(volume/massa) di vapore d acqua e rischio sovraccarico pompe qualora cambio T e P nell impianto.
...queta volta ho qualche difficoltà a capire come cambia il volume specifico del vapore d'acqua.
Le mie tabelle riportano un vapore d acqua che, all aumnetare della temperatura, aumenta la pressione e DIMINUISCE IL VOLUME SPECIFICO.
...avendo verificato che il V.S è l inverso della densità, se io dovessi riscaldare un vapore, la sua densità diminuirebbe e di conseguenza aumenterebbe il suo V.S. o sbaglio?
...le pongo un esempio che mi sono posto:
se ho una bottiglia di 1 litro riempità di vapore e volessi trasferire il vapore in una da 750 cosa dovrei fare? riscaldarlo o raffreddarlo? se lo raffreddo la sua densità diminuisce ma aumenta il suo V.S.????
spero di essere stato chiaro.....grazie
Non mi chiamare ingegnere che non lo sono, e non darmi nemmeno del lei, non ti preoccupare.
RispondiEliminaComunque il consiglio che posso darti in generale è che per capire le grandezze in gioco devi guarda le dimensioni con cui sono espresse.
Ad esempio, un volume specifico è un volume diviso una massa.
10 litri/kg vuol dire che in un kg di acqua occupa 10 litri.(volume specifico)
Allo stesso modo:
0.1 kg/litro vuol dire che un litro di acqua ha una massa di 0.1kg. (densità)
Da questo esempio si evince che VS e Densità sono uno l'inverso dell'altro.
Quello che tu chiedi è molto complicato da spiegare in questo unico intervento perchè c'è tanta termodinamica da spiegare. Cercherò di fartela facile:
Le tabelle dell'acqua sono quelle tabelle che ci dicono come cambiano le grandezze termodinamiche durante il passaggio tra liquido è vapore.
Se ad esempio guardo come varia il VS, noterai che ad un certo punto esso varierà di circa 1000 volte. Quello ci indica che c'è il passaggio di fase.
l'acqua passa da liquido a vapore in un passaggi di fase. L'acqua liquida come tu ben sai varia di poco il suo volume specifico, solitamente si assume costante.
Il vapore acqueo, dato che è quasi da considerarsi come un gas, subisce invece variazioni più sensibili.
Questo vapore immaginalo come tante molecole volanti che rimbalzano tra di loro. Queste molecole più energia hanno più possono rimbalzare a distanza maggiore e con maggiore forza.
Questo rimbalzo delle molecole causa la pressione (per quanto riguarda i gas) e quindi, più energia hanno queste molecole maggiore sarà la pressione esercitata sul volume che le contengono.
Questa energia di rimbalzo delle molecole, che chiameremo simpaticamente energia cinetica, dipende dalla temperatura. Più è alta la T e maggiore è l'energia cinetica delle molecole che quindi:
- a P costante, se T aumenta le molecole occupano un volume specifico sempre maggiore.
- a VS costante, se T aumenta le molecole rimbalzeranno sempre con maggiore violenza aumentando la pressione nel contenitore che le contiene.
Alla luce di ciò, rispondo alla domanda finale.
Ponendo un T costante, per passare il vapore in un volume più piccolo dovresti semplicemente aumentare la pressione del vapore (con un compressore ad esempio).
Ponendo una P costante, ad esempio quella atmosferica in cui viviamo, basta diminuire l'energia cinetica delle molecole, ossia si raffredda.
Dato che il VS è l'inverso della densità è ovvio che se diminuisci il volume specifico di vapore aumenti la densità.
Spero di essere stato chiaro. Saluti.
Ok insomma è come pensavo all aumentare della temperatura diminuisce la desnità e aumenta il V.M. allora dovrò interpretare meglio la mia tabella.
RispondiEliminaScusa ma ho visto solo adesso la tua età e solo adesso ho visto che sei di Cosenza e io sono di Lamezia T........grazie e ciao
ehi ciao,fatto l'esame di stato?anche io sto studiando per farlo..hai per caso altri temi?ho letto qllo pubblicato e sei stato molto kiaro e semplice..se non lo hai fatto ancora (l'esame)e vuoi anche te qlc tema per un confronto scrivi pure..
RispondiEliminaCiao, guarda ho fatto l'esame di stato e i temi sono semplicissimi e di solito passi sempre. Il difficile è quando devi fare la 4rta prova, la mia era difficilissima e non so se sono passato.
RispondiEliminaA fine marzo escono i risultati, cmq temi di ingegneria chimica ho fatto solo questo, all'esame mi è capitato "forme di conversione dell'energia in ingegneria chimica" e "le variabili dei reattori chimici nei processi di conversione.".
Salve Ing. ho un problema che solo tu puoi risolvere:
RispondiEliminaLa corrente gassosa la cui composizione è riportata nella tabella deve essere trattata per assicurare lo scarico in atmosfera a norma.
COMPONENTE.........[Kmoli/h]
toluene....................1.448
isobutanolo.............0.603
azoto......................100
Qi portata molare dell’esimo componente della miscela gassosa da sottoporre al processo di abbattimento
zi concentrazione molare del componente i-esimo della miscela isobutanolo-toluene-azoto prima del processo di abbattimento
Si suggerisce una operazione di condensazione per ridurre il carico inquinante e recuperare quanto più possibile i solventi.
Non capisco quale è il problema:
RispondiElimina1) ti calcoli le percentuali su base molare delle portate.
2) Devi trovare i dati di equilibrio a temperatura ambiente 25°C, (o una diversa se è indicata)delle 3 specie tramite qualche manuale, non so quale tu hai. Puoi considerare tranquillamente l'azoto come incondensabile.
3) Conoscendo la percentuale di inquinanti ammissibile (%Amm) fai un metodo iterativo.
Visto che ti suggerisce una condensazione, devi ipotizzare una temperatura di un apparecchiatura di separazione T_ip
Con questa T_ip devi inventarti un ciclo iterativo o a tentativi che convergerà verso la soluzione.
In poche parole il ciclo finirà quando la tua T_ip ti darà la percentuale richiesta di inquinanti.
E' un esercizio che è lunghetto, soprattutto da fare a questa ora, ma è semplice da capire.
Per il tuo ciclo iterativo puoi prendere spunto da questo file:
http://localhostr.com/files/c8f3ed/03%20Distillazione%20flash.pdf
Se vuoi invece usare un metodo a tentativi, trovati un equazione che lega T_ip alla percentuale di inquinanti e fai dei tentativi. Ti trovi una 1ma soluzione, poi una 2nda e la terza la interpoli (o la estrapoli) per avere una T_ip migliore.
A furia di fare tentativi troverai la soluzione.
Ti ho detto dei metodi molto complicati, non ricordo se sei un universitario o uno delle superiori.
Nel caso delle superiori penso che la soluzione sia molto più semplice, nel tuo libro di testo deve esserci un equazione (o un sistema di equazioni) che dovrebbe facilitarti tutto.
Fammi sapere appena hai fatto. Ciao